当您委托的业务完成后,您可以向服务顾问提出开具服务发票申请,我们将尽快给您出具相应的服务发票;第三方服务内容,由第三方为您出具相应的服务发票。
咨询电话:



重庆二类医疗器械注册证注册费用:
首次注册费:74300元
首次注册申请材料清单:
1《医疗器械注册申请表》
2监管信息
3综述资料
4非临床资料
5临床评价资料
6产品说明书和标签样稿
7质量管理体系文件
注册流程:
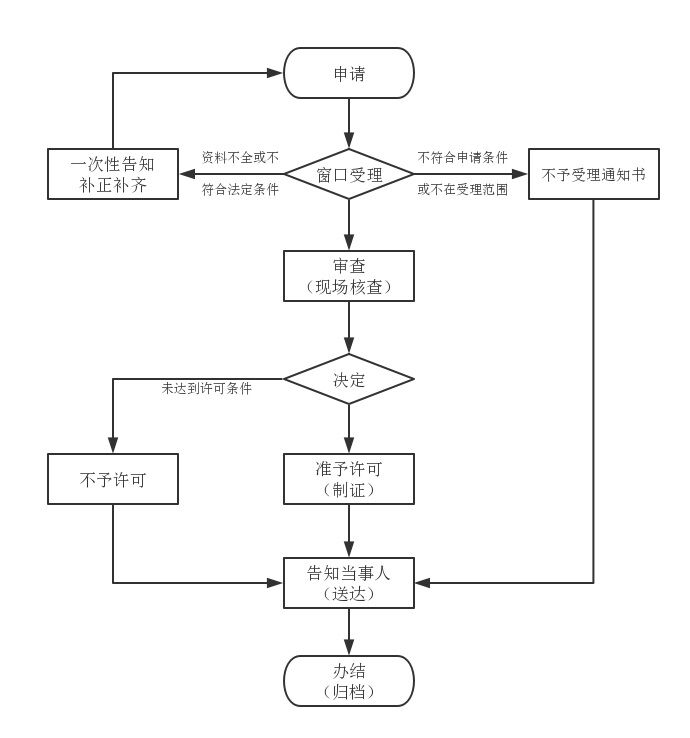
注册特别程序:
1.注册体系核查组织人:重庆市药品技术审评查验中心 时限:30个工作日
2.技术审评组织人:重庆市药品技术审评查验中心 时限:120个工作日,第二类医疗器械注册申请、变更注册申请、延续注册申请的技术审评时限为60日,申请资料补正后的技术审评时限为60日;
常见问题:
问题:1. 医疗器械注册过程中主要法律、法规、规章制度?
解答:《医疗器械监督管理条例》、《医疗器械注册与备案管理办法》、《医疗器械通用名命名规则》、《医疗器械临床试验质量管理规范》、《医疗器械生产质量管理规范》、《医疗器械说明书和标签管理规定》、《医疗器械注册申报资料要求和批准证明文件格式的公告》等。
问题:开展医疗器械临床试验有哪些规定
解答:开展医疗器械临床试验,应当按照医疗器械临床试验质量管理规范的要求,在取得资质的临床试验机构内进行。临床试验样品的生产应当符合医疗器械质量管理体系的相关要求。第三类医疗器械进行临床试验对人体具有较高风险的,应当经CFDA批准。需进行临床试验审批的第三类医疗器械目录由CFDA制定、调整并公布。临床试验审批是指CFDA根据申请人的申请,对拟开展临床试验的医疗器械的风险程度、临床试验方案、临床受益与风险对比分析报告等进行综合分析,以决定是否同意开展临床试验的过程。医疗器械临床试验应当在批准后3年内实施;逾期未实施的,原批准文件自行废止,仍需进行临床试验的,应当重新申请。
 什么时候可以拿到服务发票?
什么时候可以拿到服务发票? 
当您委托的业务完成后,您可以向服务顾问提出开具服务发票申请,我们将尽快给您出具相应的服务发票;第三方服务内容,由第三方为您出具相应的服务发票。
 支付流程
支付流程 
签订协议、材料准备、特约快递、收取票据、专属客服、商务对接、资质申报、完成办理、提供发票