当您委托的业务完成后,您可以向服务顾问提出开具服务发票申请,我们将尽快给您出具相应的服务发票;第三方服务内容,由第三方为您出具相应的服务发票。
咨询电话:


无忧退款 快速办理 材料免费邮寄 流程掌控


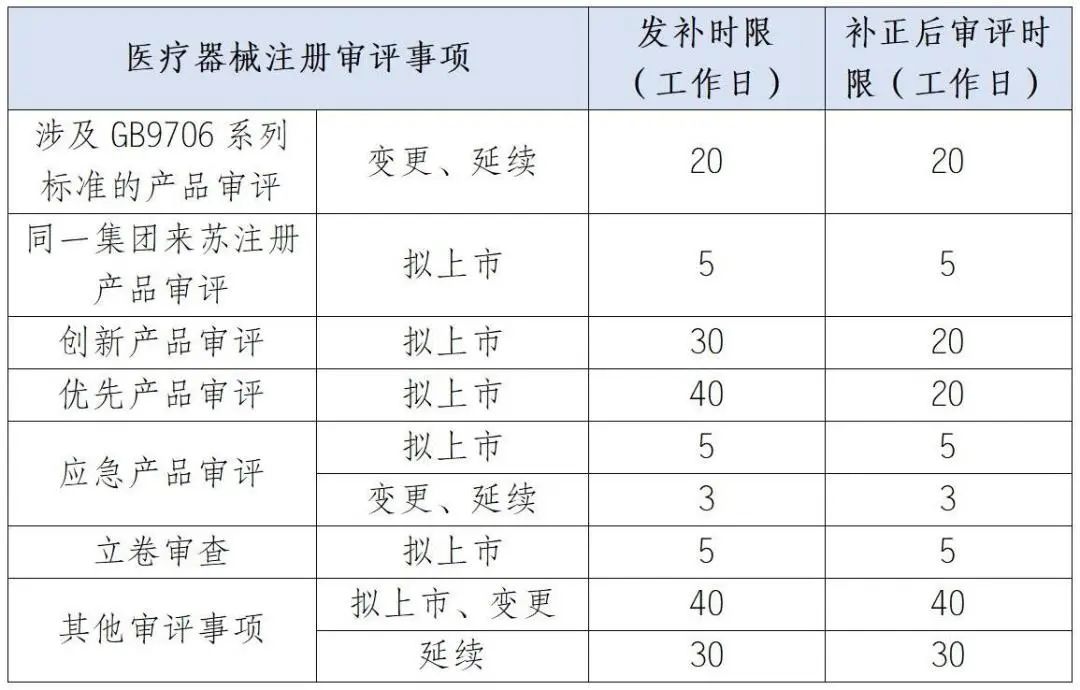
在江苏申请医疗器械产品注册审评时间需要多长?
近年来,《省政府办公厅印发关于优化审评审批服务推动创新药械使用促进医药产业高质量发展行动方案(2022-2024年)的通知》(苏政办发〔2022〕1号)、《省政府印发关于推动经济运行率先整体好转若干政策措施的通知》(苏政规〔2023〕1号)、省药监局《关于持续优化营商环境促进生物医药产业提速畅通高质量发展的若干措施》等文件,对缩减医疗器械审评时限、加快审评速度提出了具体要求,审评中心专门印发《关于严格落实第二类医疗器械注册技术审评办理时限要求的通知》文件,对医疗器械注册审评相关时限进行明确。具体审评办理时限如下:
企业新产品注册申请时,如省内尚无该类产品,但外省已有该类产品注册、上市,是否可以直接参照外省,简化分类界定相关流程。
答:不可以。产品的类别应参照现行相关法规文件,如《医疗器分类目录》、《医疗器械分类界定汇总文件》等;相关现行文件中若无该类产品,应对照《医疗器械分类规则》进行类别判定;外省已获证产品可以作为参考,但不能作为产品类别的判定依据。
什么是符合法规要求的第三方检验机构及报告?
答:符合法规要求的第三方检验机构是经国务院认证认可监督管理部门会同国务院药品监督管理部门认定的检验机构,应获得国家资质认定证书(CMA),同时检测能力领域应涉及医疗器械。
第三方检验报告应符合以下要求:(1)检验报告应加盖检验报告专用章;(2)对于产品技术要求完全采用国家标准、行业标准的,检验机构必须取得该国家标准、行业标准的资质认定,报告封面加盖资质认定标志CMA章,并在报告备注中注明。(3)产品技术要求不涉及或部分涉及国家标准、行业标准进行检验并出具报告的,应在检验报告备注中对承检能力予以自我声明,并承担相应的法律责任。自我声明内容为“该产品技术要求不涉及/部分涉及国家标准、行业标准,不能直接作为资质认定许可的依据,但本实验室对报告涉及的检验项目具备相应的承检能力”。
代办区域:
南京市、无锡市、徐州市、常州市、苏州市、南通市、连云港市、淮安市、盐城市、扬州市、镇江市、泰州市、宿迁市
 什么时候可以拿到服务发票?
什么时候可以拿到服务发票? 
当您委托的业务完成后,您可以向服务顾问提出开具服务发票申请,我们将尽快给您出具相应的服务发票;第三方服务内容,由第三方为您出具相应的服务发票。
 支付流程
支付流程 
签订协议、材料准备、特约快递、收取票据、专属客服、商务对接、资质申报、完成办理、提供发票