咨询电话:
YY/T 0316-2016 和 GB/T 42062-2022 对比变化
发布于 2024-04-01 阅读(12064)
一、总体变化
1.基本框架结构调整,0316-2016 有 9 个章,42062-2022 有 10 个章,调整更符合 ISO 标准结构要求。
2.风险管理流程基本不变,核心思路不变。风险管理的一般流程(分析、评价、控制、综合剩余风险 评价、风险管理评审、生产和生产后活动)编辑性改动,没有大的差异。
3.GB/T42062 和 ISO/TR 24971 紧密结合,0316-2016 原来有 10 个附录,42062-2022 有 3 个附录,去掉 的附录迁移至 YY/T1437(ISO/TR 24971)。
4.术语变化:新增 3 个定义:3.2 受益;3.15 可合理预见的误使用;3.28 最新技术水平。
5.条款变化:8 综合剩余风险的可接受性评价改为综合剩余风险评价,二者意思不同,新版标准明确如 果受益不大于综合剩余风险,制造商可以考虑实施额外的风险管理措施或修改医疗器械或预期用途,否则 综合剩余风险不可接受;9 风险管理报告改为风险管理评审,从报告上升到评审;10 生产和生产后信息改 为生产和生产后活动,从信息改为活动细分内容。
二、基本框架结构对比
42062 仅增加条款 2 ;9 、10 条款编辑性改变,其他保持不变。
0316-2016( ISO 14971:2007) | 42062-2022( ISO 14971:2019) | 对比变化 |
1.范围 | 1.范围 | 保持一致 |
--------- | 2.规范性引用文件 | 增加 |
2.术语和定义 | 3.术语和定义 | 保持一致 |
3.风险管理通用要求 | 4.风险管理通用要求 | 保持一致 |
4.风险分析 | 5.风险分析 | 保持一致 |
5.风险评价 | 6.风险评价 | 保持一致 |
6.风险控制 | 7.风险控制 | 保持一致 |
7.综合剩余风险评价 | 8.综合剩余风险评价 | 保持一致 |
8.风险管理报告 | 9.风险管理评审 | 编辑性变化 |
9.生产和生产后信息 | 10.生产和生产后活动 | 编辑性变化 |
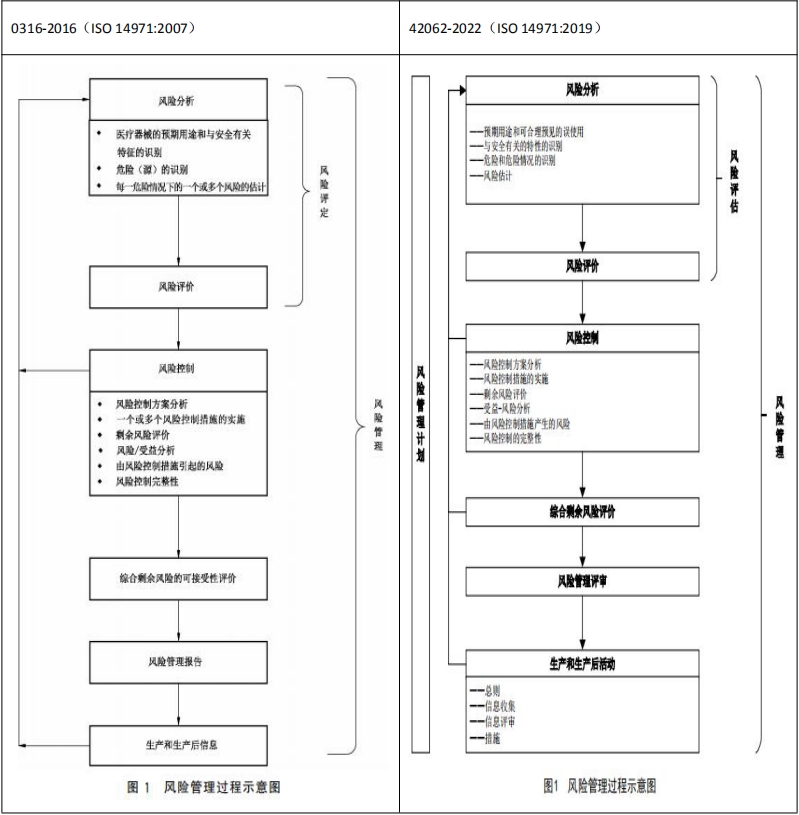
三、风险管理过程对比
42062-2022 大的过程风险分析→风险评价→风险控制→综合剩余风险评价→风险管理评审→生产和生产后活动,和 0316-2016 的过程基本一致,只有个别编辑性改变。过程中的条内容稍作编辑性或拆分,但大的方向保持不变。
四、条款对比
0316-2016(ISO 14971:2007) | 42062-2022(ISO 14971:2019) | 对比变化 |
引言 | 引言 | ------ |
1.范围 | 1.范围 | 基本一致 |
------------- | 2.规范性引用文件 | 增加条款 |
2.术语和定义 | 3.术语和定义 | ------ |
2.1 随附文件 | 3.1 随附文件 | 保持一致 |
------------- | 3.2 受益 | 增加术语 |
2.2 伤害 | 3.3 伤害 | 保持一致 |
2.3 危险(源) | 3.4 危险 | 基本一致 |
2.4 危险情况 | 3.5 危险情况 | 保持一致 |
2.5 预期用途 预期目的 | 3.6 预期用途 预期目的 | 保持一致 |
2.6 体外诊断医疗器械 IVD 医疗器械 | 3.7 体外诊断医疗器械 IVD 医疗器械 | 保持一致 |
2.7 生命周期 | 3.8 生命周期 | 保持一致 |
2.8 制造商 | 3.9 制造商 | 保持一致 |
2.9 医疗器械 | 3.10 医疗器械 | 基本一致 |
2.10 客观证据 | 3.11 客观证据 | 保持一致 |
2.11 生产后 | 3.12 生产后 | 保持一致 |
2.12 程序 | 3.13 程序 | 保持一致 |
2.13 过程 | 3.14 过程 | 保持一致 |
------------- | 3.15可合理预见的误使用 | 增加术语 |
2.14 记录 | 3.16 记录 | 保持一致 |
2.15 剩余风险 | 3.17 剩余分析 | 保持一致 |
2.16 风险 | 3.18 风险 | 保持一致 |
2.17 风险分析 | 3.19 风险分析 | 保持一致 |
2.18 风险评估 | 3.20 风险评估 | 保持一致 |
2.19 风险控制 | 3.21 风险控制 | 保持一致 |
2.20 风险估计 | 3.22 风险估计 | 保持一致 |
2.21 风险评价 | 3.23 风险评价 | 保持一致 |
2.22 风险管理 | 3.24 风险管理 | 保持一致 |
2.23 风险管理文档 | 3.25 风险管理文档 | 保持一致 |
2.24 安全 | 3.26 安全 | 保持一致 |
2.25 严重度 | 3.27 严重度 | 保持一致 |
------------ | 3.28最新技术水平 | 增加术语 |
2.26 最高管理者 | 3.29 最高管理者 | 保持一致 |
2.27 使用错误 | 3.30 使用错误 | 保持一致 |
2.28 验证 | 3.31 验证 | 保持一致 |
3 风险管理通用要求 | 4 风险管理系统通用要求 | 编辑性改变 |
3.1 风险管理过程 | 4.1 风险管理过程 | 保持一致 |
3.2 管理职责 | 4.2 管理职责 | 保持一致 |
3.3 人员资格 | 4.3 人员能力 | 编辑性改变 |
3.4 风险管理计划 | 4.4 风险管理计划 | 保持一致 |
3.5 风险管理文档 | 4.5 风险管理文档 | 保持一致 |
4 风险分析 | 5 风险分析 | 保持一致 |
4.1 风险分析过程 | 5.1 风险分析过程 | 保持一致 |
4.2 医疗器械预期用途和与安全相关特 征的识别 | 5.2 预期用途和可合理预见的误使用 | 编辑性拆分改变 |
| 5.3 与安全有关的特性的识别 | ||
4.3 危险(源) 的识别 | 编辑性改变 | |
4.4 估计每个危险情况的风险 | 5.5 风险估计 | 编辑性改变 |
5 风险评价 | 6 风险评价 | 保持一致 |
6 风险控制 | 7 风险控制 | 保持一致 |
6.1 降低风险 | ------ | 条款删除 |
6.2 风险控制方案分析 | 7.1 风险控制方案分析 | 保持一致 |
6.3 风险控制措施的实施 | 7.2 风险控制措施的实施 | 保持一致 |
6.4 剩余风险评级 | 7.3 剩余风险评级 | 保持一致 |
6.5 风险/受益分析 |
7.4 受益-风险分析 | 编辑性改变(如果受益不大于剩余风险,企业可以改变预期用途,否则评价为不可接受) |
6.6 由风险控制措施产生的风险 | 7.5 由风险控制措施产生的风险 | 保持一致 |
6.7 风险控制的完整性 | 7.6 风险控制的完整性 | 保持一致 |
7 综合剩余风险的可接受性评价 | 综合剩余风险评价 | 编辑性改变(如果受益不大于剩余风险,企业可以改变预期用途,否则评价为不可接受) |
8 风险管理报告 | 9 风险管理评审 | 编辑性改变 |
9 生产和生产后信息 | 10 生产和生产后活动 | 编辑性改变 |
| 10.1总则 | 增加具体内容 | |
| 10.2信息收集 | ||
| 10.3信息评价 | ||
| 10.4措施 | ||
附录 A 各项要求的原理说明 | 附录 A 各项要求的说明 | 编辑性改变 |
附录 B 医疗器械风险管理过程概述 | 附录 B 医疗器械风险管理过程 | 编辑性改变 |
附录 C 用于识别医疗器械与安全有关特 征的问题 | 移至YY/T 1437 | 内容迁移 |
附录 D 用于医疗器械的风险概念 | ||
附录 E 危险(源) 、可预见的事件序列 和危险情况示例 | 附录C 基本风险概念 | 附录内容变化 |
附录 F 风险管理计划 | 移至YY/T 1437 | 内容迁移 |
附录 G 风险管理技术资料 | ||
附录 H 体外诊断医疗器械风险管理指南 | ||
附录 I 生物学危险(源) 的风险分析过程 指南 | 附录删除 | ----- |
附录 J 安全信息和剩余风险信息 | 移至YY/T 1437 | 内容迁移 |
参考文献 | 参考文献 | ----- |
本文标签:
热门排行
- YY/T0316-2016 废止!升级替代为GB/T 42062-2022标准 2023-11-24
- YY/T 0316-2016 和 GB/T 42062-2022 对比变化 2024-04-01
- 办理了食品生产许可证是否还需要办理食品经营许可证 2020-02-04
- 办理了小作坊登记证和食品经营许可证自己加工的食品可以在网上销售吗? 2018-09-23
- 潍坊市政务服务大厅有关服务电话 2020-02-07
- 泰安市行政审批服务局办事窗口联系电话 2020-02-24
- 一次性医用外科口罩属于二类医疗器械吗? 2020-02-15